2016年高考化學正在復習中,為了使同學們更好的復習高考化學,比網校在線高考網小編整理的《2016高考化學知識點:化學鍵類型》,供同學們參考學習。
化學鍵類型:離子鍵、共價鍵、配位鍵、金屬鍵(氫鍵不是化學鍵)。
離子鍵
通過電荷轉移而形成兩種帶相反電荷的離子,它們之間存在靜電引力,這種鍵叫“離子鍵”。
例如:金屬鈉和氯氣發生反應,生成氯化鈉。
2Na+Cl2=2NaCl
鈉的原子序數是11,其核外電子排布是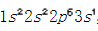 ,最外層有一個電子,容易失去一個電子形成穩定結構。氯的原子序數是17,其核外電子排布是
,最外層有一個電子,容易失去一個電子形成穩定結構。氯的原子序數是17,其核外電子排布是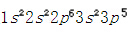 ,最外層有七個電子,容易得到一個電子形成穩定結構。從而鈉失去一個電子,成為一個帶正電荷的正離子,具有氖的電子構型;氯得到一個電子,成為一個帶負電荷的負離子,具有氬的電子構型。最外層都達到八電子的穩定狀態(八隅體)。鈉正離子和氯負離子間存在靜電吸引力,于是陰陽離子間形成了穩定的化學鍵。
,最外層有七個電子,容易得到一個電子形成穩定結構。從而鈉失去一個電子,成為一個帶正電荷的正離子,具有氖的電子構型;氯得到一個電子,成為一個帶負電荷的負離子,具有氬的電子構型。最外層都達到八電子的穩定狀態(八隅體)。鈉正離子和氯負離子間存在靜電吸引力,于是陰陽離子間形成了穩定的化學鍵。
共價鍵
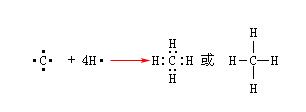
由原子各提供的電子形成電子對,共享而形成的化學鍵叫“共價鍵”。例如CH4。
碳是位于元素周期表中第二周期第四族的元素,處于中間位置,外層有四個價電子,既不容易失去也不容易得到四個電子形成穩定的八電子結構。也就是說碳原子不可能形成C4+或C4-。因此,當碳原子和其他元素形成化合物時,為了要達到穩定的電子構型,就和其他原子各提供的電子形成兩個原子共用的電子對。碳有四個單電子,它可以和四個氫原子形成四個共價鍵而生成甲烷。
配位鍵
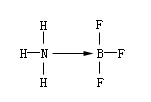
由一方原子提供電子而形成的化學鍵叫“配位鍵”。例如,三氟化硼和氨分子形成配位鍵。因為硼外層有三個電子,可以與三個氟原子形成三氟化硼(BF3),這樣硼的外層共有六個電子,還有空軌道,還能容納其他電子對。氨分子中的氨上有孤電子對,可以和硼結合形成配位鍵。
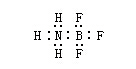
這種鍵是由一方提供電子給另一方,所以可以用箭頭(→)表示,箭頭所指方向是給電子方向或用下式表示:
再如胺生成銨鹽的反應:
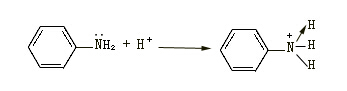
配位鍵也叫配位共價鍵,是屬于共價鍵的一種。
下面把配位鍵與普通共價鍵和離子鍵作一比較。無論配位鍵或普通共價鍵,生成后在本質上并無差別,可用銨離子說明這一點。銨離子具有由氨分子未共用電子對和質子(H+)配位而形成的配位共價鍵,是正四面體結構,說明原來構成氨分子的三個N-H共價鍵和由于配位而形成的共價鍵,完全是等價的,所以共價鍵與配位鍵盡管在形成過程上有所不同,但鍵的本身并沒有本質上的差別。
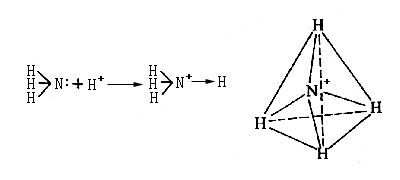
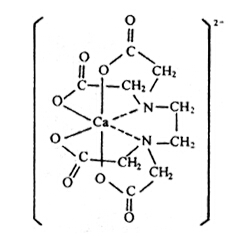
然而,配位鍵的形成是一種原子把電子給與另一種原子的過程,使成鍵的兩個原子分別帶有正負電荷。因此,配位共價鍵多數有極性,有時也叫做半極性鍵。極性的大小可以在偶極矩上反映出來,所以有配位鍵的化合物一般都有較大的偶極矩,而與離子鍵化合物的數值大小相當。因此,有配位鍵的化合物雖然是有機化合物,但卻有難溶于有機溶劑而易溶于水和以高熔點的晶體形式存在等和鹽類相似的性質。但配位鍵和離子鍵有本質上的不同,離子鍵是依賴于庫侖靜電引力結合起來的,而配位鍵除有庫侖力外還有電子的離域力,所以有配位鍵的化合物,即使在水溶液里化學鍵也保持不變。例如,乙二胺四乙酸和鈣離子反應生成鹽的同時,還有由非常強的配位鍵生成的穩定的水溶性離子。這個絡陰離子是穩定的,已不能與碳酸根離子生成沉淀,而且進行電解時含鈣的組分移向陽極一側。
金屬鍵
金屬鍵是通過自由運動著的電子把金屬內部的金屬原子和金屬離子結合在一起而成的鍵,如:
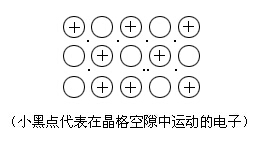
有機分子中的原子主要是以共價鍵相結合的,所以在有機化學中重點討論的是共價鍵。
